پست ثابت
chemmeybod@yahoo.com
chemmeybod@gmail.com
chemmeybod@yahoo.com
chemmeybod@gmail.com
پوشش دسته ها برای تمیز شدن ساده تر کاملا جدا می شود و یک نور در انتهای دسته چنگال وجود دارد که وقتی خوب غذا می خورید سبز می شود و یا وقتی سرعت غذاخوردن خود را زیاد می کنیم علاوه بر این ه به لرزش در آمد، این نور قرمز می شود.

بالا بودن گرمای ویژه آب از تغییرات زیاد دمای سطح زمین جلوگیری میکند. حجم عظیم آب در اقیانوسها و دریاها گرمای خورشید را در طول روز جذب کرده ، بدون تغییر دمای قابل ملاحظهای آن را شب به اتمسفر بر میگردانند. در روی کره ماه که آب وجود ندارد و سطح آن صخرههایی با گرمای ویژه پایین ( یک پنجم گرمای ویژه آب ) تشکیل شده است، گستره دمایی میتواند از 150 درجه تا 120 درجه تغییر کند.
تعریفی از محلولهای کلوئیدی
محلولهای کلوئیدی را محلولهای چسب مانند نیز میگیوند. پراکندگی ذرات آنها به صورت پراکندگی یونی و مولکولی نیست، بلکه به صورت مجموعههای مولکولی به نام "میسل" می باشند که به راحتی از حلال قابل تشخیص هستند، مانند ذرات گچ یا قطرات روغن زیتون در آب ، بطوری که محلولهای غیر حقیقی یا همان محلولهای کلوئیدی مخلوط یکنواخت نیستند.
تفاوت محلولهای کلوئیدی و سوسپانسیون با محلولهای حقیقی
در محلولهای کلوئیدی و سوسپانسیون مسیر نور مشخص است و نور در آن منعکس و پراکنده میشود. ولی در محلول حقیقی مسیر نور مشخص نیست (عبور نور بدون انتشار صورت می گیرد) و ذرات کلوئیدی برخلاف محلول حقیقی قابلیت دیالیز ندارند. یعنی از غشای نیم تراوا عبور نمیکنند. بنابراین از روش دیالیز برای جدا کردن اجسام این دو دسته استفاده میکنند.
تفاوت محلولهای کلوئیدی و محلولهای سوسپانسیون
گفتیم که ماهیت محلولهای کلوئیدی و محلول سوسپانسیون یکی است و در اصل سوسپانسیون ، زیر مجموعهای از محلول کلوئیدی به حساب میآید. تنها تفاوت در اندازه ذرات است. اندازه ذرات محلولهای سوسپانسیون و امولسیون بزرگتر از محلول کلوئیدی و اندازه محلولهای کلوئیدی بزرگتر از محلول حقیقی است. در محلولهای کلوئیدی واحدهای جسم محلول خود به خود ذراتی حجیم میباشند و یا اینکه از چندین مولکول بزرگ مجتمع شده بدست آمده است. نشاسته به وزن مولکولی تقریبی 32000 از نوع اول و گوگرد از نوع دوم است.
این ذرات که امکان دارد از چندین هزار مولکول تشکیل شده باشد، به قدری ریز است که با چشم غیر مسلح دیده نمیشود و در نتیجه چنین محلولی در صورت ظاهر به محلول حقیقی شباهت پیدا میکند. لیکن اگر ذرات به بزرگی 6-10 میلیمتر ، به بزرگی 3-10 میلیمتر برسد، با میکروسکوپ قابل رویت میگردد و در نتیجه نام محلول کلوئیدی به محلول سوسپانسیون تبدیل میشود و لذا حالت کلوئیدی را میتوان حالت واسطه بین محلول واقعی و محلول سوسپانسیون دانست.
تفاوت محلول امولسیون و محلول کلوئیدی
امولسیون ، کلوئیدی است که در آن ذرات معلق یک مایع در مایع دیگر است. مانند تعلیق روغن در آب . در حالیکه سوسپانسیون ذرات معلق جامد در مایع است.
تبدیل کلوئیدی و سوسپانسیون به لخته
به هم چسبیدن ذرات کلوئید و سوسپانسیون یا معلق را به یکدیگر و ته نشین شدن آنها را به صورت ذرات بزرگتر ، لخته شدن میگویند و اگر به صورت توده نیمه جامد تبدیل شوند، آن را ژله شدن مینامند.
در بخش 5 شیمی سال دوم دبیرستان ، که به تازگی تغییراتی در آن ایجاد شده است ، می خوانیم : « در هر لایه از گرافیت ، هر اتم کربن با 4 پیوند و با آرایش سه ضلعی مسطح به سه اتم کربن دیگر متصل است » . آیا واقعاً هر اتم کربن 4 پیوند تشکیل داده است یا 3 پیوند ؟
اتم های کربن پیش از تشکیل پیوند ، می بایست برانگیخته شوند ، یعنی از آرایش 1s2 2s2 2p2 به آرایش 1s2 2s1 2p3 درآیند . سپس اوربیتال 2s با دو اوربیتال x , y از زیر لایه ی 2p هیبرید می شوند و سه اوربیتال sp2 تشکیل می دهند . حال این سه اوربیتال تک الکترونی از هر اتم در تشکیل سه پیوند یگانه σ ( سیگما ) با آرایش سه ضلعی مسطح شرکت می کنند . اما تکلیف تک الکترون باقیمانده در اوربیتال هیبرید نشده ی 2pz چه می شود ؟ آیا این اوربیتال در تشکیل پیوند شرکت نمی کند ؟ منابع علمی می نویسند که این الکترون نامستقر است . آیا این جمله بدین معنی است که این الکترون در همان اوربیتال اولیه اش باقی می ماند و در موقع لزوم از آن فرار می کند ؟ نامستقر بودن الکترون چهارمِ هر اتم کربن ، به معنی عدم تشکیل پیوند اوربیتال دربردارنده ی آن نیست . در اینجا همان اتفاقی که در بنزن می افتد ، رخ خواهد داد . به این گونه که اوربیتال های 2pz اتم های مجاور همپوشانی کرده ، پیوند جانبی π (پای) تشکیل می دهند . از آنجایی که در هر لایه از گرافیت ، تعداد اتم های کربن بسیار زیاد است ، یک ابر الکترونی گسترده از این پیوند ها تشکیل می شود که الکترون های موجود در این ابر ، به راحتی می توانند در سرتاسر لایه حرکت کنند و جریان الکتریکی را انتقال دهند .
این موضوع را می توان بر اساس همپوشانی باند ظرفیت و باند رسانایی در گرافیت توصیف کرد
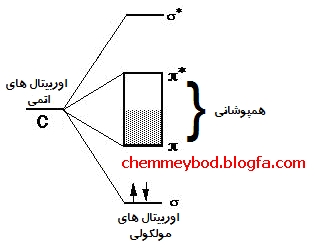
وجود جاذبه ی واندروالسی ( لوندون ) بین لایه های گرافیت را نیز می توان به پیدایش قطبیت های لحظه ای در این ابرها و القای آن به ابرهای مجاور نسبت داد .
گرافن (Graphene) نامِ یکی از آلوتروپ های کربن است. این ماده در حقیقت یک لایه از گرافیت است .

هر چند نخستین بار در سال ۱۹۴۷ فیلیپ والاس دربارهٔ گرافن نوشت و سپس از آن زمان تلاشهایِ زیادی برایِ ساختِ آن صورت گرفته بود اما تا سال ۲۰۰۴ طول کشید تا این ماده ساخته شود . در این سال آندره گایم و کنستانتین نووسلف ، از دانشگاه منچستر موفق به ساختِ این ماده شدند و جایزهٔ نوبل فیزیک 2010 را به خاطرِ ساختِ این ماده ی دوبعدیاز آنِ خود کردند .